路 哥 Master
用 足 够 的 思 考 认 知 世 界
本文主要内容如下:
> 中国新冠疫苗的信息重点;
> 美国辉瑞公司(pfizer)疫苗的信息重点;
> 俄罗斯新冠疫苗的信息重点;
> 什么是灭活疫苗;
> 什么是mRNA疫苗;
> 疫苗研发的一般过程。
- - - - - - - - - - - - - - - - - - - - - - - - - - - -

▶▶ 中国新冠疫苗的信息重点
1、中国新冠疫苗主要由中国医药集团有限公司(简称“国药集团”)进行研发,历时347天。
中国医药集团有限公司是由国务院国资委直接管理的唯一一家以医药健康产业为主业的中央医药企业,是国家创新型企业,是中央医药储备单位,是中国和亚洲综合实力和规模领先的综合性生命健康产业集团,拥有集科技研发、工业制造、物流分销、零售连锁、医疗健康、工程技术、专业会展、国际经营、金融投资等为一体的大健康全产业链。旗下有1500余家子公司和6家上市公司,员工总人数15万人。
点击这里进入国药集团官网 ▷▷▷
2、12月31日上午,国务院联防联控机制举行新闻发布会,介绍新冠病毒疫苗有关情况。
国家卫生健康委员会副主任、国务院联防联控机制科研攻关组疫苗研发专班负责人曾益新说,新冠病毒疫苗肯定是为全民免费提供。据介绍,国药集团中国生物新冠灭活疫苗已获得国家药监局批准附条件上市。已有数据显示,保护率为79.34%,实现安全性、有效性、可及性、可负担性的统一,达到世界卫生组织及国家药监局相关标准要求。后续,疫苗免疫的持久性和保护效果还需持续观察。
3、国药集团中国生物新冠灭活疫苗在阿联酋和巴林等多个国家进行了大规模的Ⅲ期临床试验,接种人数已经超过了6万人,接种人群样本量涵盖了125个国籍,完成了阶段性保护率数据的评价,目前得到的结果好于临床研究预定的目标,安全性和有效性指标超过了世界卫生组织规定的上市标准和我们国家批准的附条件上市工作方案的要求,可以在大范围人群中形成有效保护。
4、阿联酋卫生和预防部12月9日批准国药集团中国生物新冠灭活疫苗注册上市,这是全球第一个正式获批注册上市的新冠疫苗,巴林国家卫生监管局12月13日也批准国药集团中国生物新冠疫苗正式注册上市,临床试验数据审核结果显示,疫苗有效性达到86%,中和抗体血清转化率99%,预防中度和重度疾病的有效性100%。阿联酋、巴林均为世界卫生组织成员国,其药品疫苗监管体系和注册上市标准符合相关国际准则。
阿联酋采用的是世卫组织技术标准并参考美国食药监局病例诊断标准,即新冠病毒检测阳性+1个临床症状,与同时期所批准的美国辉瑞公司的标准一致。两者的分析数据也有一致性,例如中和抗体阳转率都是99%以上。疫苗是安全有效的。
5、在阿联酋等国政府和中国驻外使领馆的大力帮助下,在中国疾病预防控制中心与河南省疾控中心专家现场指导下,中国生物新冠灭活疫苗Ⅲ期临床研究创造了多项全球第一:已接种6万人,入组接种人数全球第一;志愿者涵盖125个国籍,覆盖人群及其所属国别量全球第一。
6、国药集团中国生物分别在北京和武汉建成的新冠灭活疫苗高等级生物安全生产车间,经国家有关部门检查和认证后,已投入规模化生产,其中北京生产基地设计年产能为1.2亿剂,目前正在扩建,预计明年产能有望达到10亿剂。
7、12月2日,国务院副总理孙春兰、国务委员王勇在北京调研新冠病毒疫苗研发和生产准备工作时指出,目前国产新冠疫苗已有5条技术路线的14个疫苗进入临床试验,其中5个疫苗正在按程序按标准开展三期临床试验,紧急使用、生产准备各项工作有序推进。这5个进入三期临床的新冠疫苗分别是国药集团下属武汉生物研究所的灭活疫苗;国药集团下属北京生物研究所的灭活疫苗;军科院联合康希诺公司研发的腺病毒载体疫苗;安徽智飞龙科马生物制药有限公司的重组蛋白疫苗;北京科兴中维生物技术有限公司的灭活疫苗。
8、目前国药集团研发的新冠灭活疫苗目前接种的所有志愿者中尚未出现一例重度不良反应,所产生的不良反应多为轻度,最常见的不良反应也为接种部位的局部疼痛。
9、国内新冠疫苗都是2℃~8℃运输条件,其中灭活疫苗的冷链保存周期是36个月,对冷链运输要求友好,在未来向全球供应新冠疫苗过程中,优势明显。(运输条件是疫苗能够普及的非常重要的条件)
10、另外,由于中国境内已经有效控制住了疫情的发展,病例样本很少,所以疫苗的研发过程中与其他国家展开了广泛的合作。
- - - - - - - - - - - - - - - - - - - - - - - - - - - -

▶▶ 美国辉瑞公司(pfizer)疫苗的信息重点
1、辉瑞公司创建于1849年,迄今已有170年的历史,总部位于美国纽约,是全球最大的以研发为基础的生物制药公司。
辉瑞公司的产品覆盖了包括化学药物、生物制剂、疫苗、健康药物等诸多广泛而极具潜力的治疗及健康领域,同时其卓越的研发和生产能力处于全球领先地位。
点击这里进入辉瑞公司英文官网 ▷▷▷
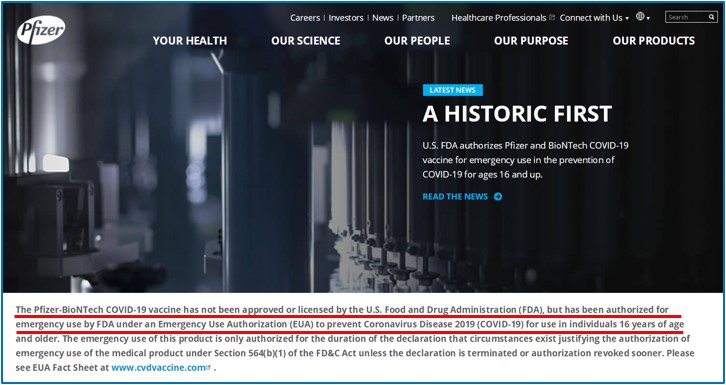
2、辉瑞官网明确声明(下图):
Pfizer-BioNTech公司的新冠疫苗尚未被美国食品药品监督局(FDA)批准及许可,但是根据防止新冠疫情的紧急使用授权,由FDA授权用于紧急使用,为16岁以及16岁以上人群接种。(Pfizer和BioNTech是两家不同公司,在新冠疫苗研发上进行合作。一般来说美国FDA的批准和授权流程非常严苛,通常会有非常长的批准流程,且时间很长。)
3、辉瑞公司中文官网信息显示,辉瑞公司的疫苗为mRNA型疫苗,名称为BNT162b2,有效率为95%,迄今为止未观察到严重的安全问题。
4、这种疫苗对于未曾感染新冠病毒的参与者(第一主要目标)和既往有新冠病毒感染史的参与者(第二主要目标)的有效率为95%(p <0.0001),每种情况都从第二次接种后的7天开始检测。最初的主要客观性分析是基于170例新冠肺炎确诊病例。这一申请还得到了收集到的大约8000名18岁及以上参与者随机亚组的安全性数据、以及大约38000名试验参与者主动提供的安全性数据的支持,这些参与者在第二次接种候选疫苗后接受了两个月的中位随访期。提交的申请材料还包括,收集到的大约100名12-15岁儿童的安全性数据。在三期研究中,大约42%的全球参与者和30%的美国参与者具有不同种族和族裔背景,41%的全球参与者和45%的美国参与者年龄在56-85岁之间。迄今为止,该研究的数据监测委员会(DMC)尚未报告任何与疫苗有关的严重安全问题。
5、BNT162b2疫苗的运输条件非常苛刻,在确保温度-70℃±10℃保存条件下可保存15天,解冻后,疫苗瓶可以在冷藏2-8℃条件下储存5天。(-70℃的运输条件造成运输成本很高,而且对于基础设施欠发达的发展中国家,疫苗的转运和分发会有很大问题。)
- - - - - - - - - - - - - - - - - - - - - - - - - - - -

▶▶ 俄罗斯新冠疫苗的信息重点
1、2020年11月份,路透社报道,俄罗斯主权财富基金表示,据中期试验结果显示,俄罗斯Sputnik V疫苗(卫星疫苗)在预防新冠病毒感染方面的有效性达到92%。据悉,俄罗斯是首个在8月注册Sputnik V疫苗供公众使用的国家。
2、也在11月份,俄罗斯又放出了一个重磅消息,该国第二种新冠疫苗也在生产当中了。第二款疫苗被命名为EpiVacCorona,是该国一家著名的病毒学研究所研发的产品。
3、有关俄罗斯疫苗的详细信息非常缺乏,因此外界对俄罗斯疫苗的信息多抱有怀疑态度。8月份,世卫组织总干事高级顾问布鲁斯·艾尔沃德对外表示 ,本着负责的态度,关于俄罗斯新冠疫苗,目前还未有足够信息可以做出判断。
4、另外,有消息称伊朗在与俄罗斯合作进行疫苗的研发。
- - - - - - - - - - - - - - - - - - - - - - - - - - - -
▶▶ 什么是灭活疫苗
灭活疫苗又称死疫苗,是指利用加热或甲醛等理化方法将人工大量培养的完整的病原微物杀死,使其丧失感染性和毒性而保持免疫原性,并结合相应的佐剂而制成的疫苗。
灭活疫苗是先对病毒或细菌培养,然后用加热或化学剂(通常是福尔马林)将其灭活。灭活疫苗即可由整个病毒或细菌组成,也可由它们的裂解片段组成为裂解疫苗。裂解疫苗的生产,是将微生物进一步纯化,直至疫苗仅仅包含所需的抗原成分(如肺炎球菌多糖)。它既可以是蛋白质疫苗,也可以是多糖疫苗。蛋白质疫苗包括类毒素(灭活细菌毒素)和亚单位疫苗。大多数多糖疫苗由来自细菌纯化的细胞壁多聚糖组成;结合疫苗是将多糖用化学方法与蛋白质连接而得到的疫苗,从而成为更有效的疫苗。
灭活疫苗常需多次接种,接种1剂不产生具有保护作用的免疫,仅仅是“初始化”免疫系统。必须接种第2剂或第3剂后才能产生保护性免疫。它引起的免疫反应通常是体液免疫,很少甚至不引起细胞免疫。接种灭活疫苗产生的抗体滴度随着时间而下降,因此,一些灭活疫苗需定期加强接种。灭活疫苗通常不受循环抗体影响,即使血液中有抗体存在也可以接种(如在婴儿期或使用含有抗体的血液制品后);它在体内不能复制,可以用于免疫缺陷者。
目前我国使用的灭活疫苗有百白破疫苗、流行性感冒疫苗、狂犬病疫苗和甲肝灭活疫苗等。
灭活疫苗使受种者产生以体液免疫为主的免疫反应,它产生的抗体有中和、清除病原微生物及其产生的毒素作用,对细胞外感染的病原微生物有较好的保护效果。灭活疫苗对病毒、细胞内寄生的细菌和寄生虫的保护效果较差或无效。
- - - - - - - - - - - - - - - - - - - - - - - - - - - -
▶▶ 什么是mRNA疫苗
mRNA疫苗是最新科技产品,这里的m,代表的是messenger :信使、邮递员,是生物遗传学工作中的一种代码,细胞中的某些蛋白酶,根据这些RNA中的代码,利用细胞质中的原料,合成某种蛋白质。这些mRNA是一次性的,用完了就溶解掉了,生成的蛋白质会诱使人体防御机制生成某种物质(抗体),专门针对这些蛋白质,且带有记忆性。
今后遇到病毒体上面带有这种蛋白质,抗体就会辨认出来,蜂拥而上,阻止蛋白质与体细胞发生作用,并且人体的免疫系统会拉响警报,大量生产这样的抗体,速率超过病毒的复制,就达到了免疫的目的。
这是目前分子生物学的巅峰技术,辉瑞公司就是利用新冠病毒中的RNA片段,找到合成特异蛋白的那一小段,用基因剪切技术,让某种酶快速复制大量的小片段,然后用某种有机物(脂类物质,相当于油膜)包裹起来,形成一个个微胶囊。把这些微胶囊收集起来,放在小瓶子里面,就成为疫苗,好处就是,这些疫苗没有病毒的框架结构,它的作用就是指导人体细胞合成蛋白质而已。
使用的时候,用针将这些微胶囊注射到人体肌肉组织,微胶囊外壳被溶解,mRNA顺利进入细胞中,被蛋白酶认出来,开始工作。要产生足以抵抗新冠病毒的抗体,至少需要7-10天(据说)。这项技术的难点在于:mRNA本质上就是一段核酸分子,十分脆弱,对温度、光照极其敏感,辉瑞公司的运输储存指导文件表示,这种东西必须储存在零下75摄氏度,也就是说,全程运输必须放在冰柜里面,就算这样,疫苗的有效期也不会超过半年。
但是,作为医学史上第一种mRNA疫苗,人类对它的副作用几乎是无知状态,尽管有了很多动物实验和为数不多的人体实验(三期临床试验),可是从生物科技、医药科技、病毒学、遗传学等方面看,这么短时间内,难以对其进行全面的实验分析。
- - - - - - - - - - - - - - - - - - - - - - - - - - - -
▶▶ 疫苗研发的一般过程
一支疫苗从研发到投入市场,再被人们接种需要走五步: 研发 → 注册 → 生产 → 流通 → 使用。
1、研发阶段。
研发是一场持久战,从最初的毒株选择、工艺稳定性的实验,到完成临床研究的整个过程,都称为研发阶段。具体分为:实验室研制、临床前研究、临床试验。 实验室研制需要无数次的反复尝试才能得到预期的疫苗。实验室研制的疫苗要进行临床前研究,这一阶段需要鼠、豚鼠、兔子的动物实验,必要时还要上猴体实验。在所有动物安全性评价的前提下,理论上已经确保了疫苗的安全有效、工艺可控、质量稳定,这时可以向食品药品监管总局申请临床试验,申报临床根据预防与治疗不同类型,一般需报11-31套资料不等,经过多轮审核合格后,企业可以拿到疫苗临床批件。临床实验分为I/II/III期三个研究阶段,III期临床试验结束,获得预期临床保护效果,安全性良好,企业可将临床资料递交食品药品监管总局药审中心申报注册生产批件。全部临床试验时间一般至少3-6年,甚至长达十几年不等。
2、注册阶段。
申报注册生产的过程中要经过食品药品监管总局药审中心不同领域专家的审评。资料符合要求,生产车间符合要求,并在车间内进行三批生产车间系统验证,三批疫苗一致性系统验证以及三批中国食品药品检定研究院(中检院)送检样品验证,验证均为生产全过程的系统性动态验证,从投料开始到原液等中间产品,包括生产的各个环节一直到最终产品,必须随时抽样检定合格,才能拿到三批中检院合格样品质检报告。食品药品监管总局药审中心重新将全部申报生产的申报资料审核无误,符合疫苗生产国家新版药典质量标准,食品药品监管总局给企业核发生产批件、注册证书等。这个过程一般需要2-5年。
3、生产阶段 。
企业拿到注册生产批件后,方可在车间生产疫苗,每批疫苗生产出后,送至中检院进行抽样检定,检定合格后拿到批签发合格证。
4、流通阶段。
在疫苗的流通环节,要严格按照《疫苗流通和预防接种条例》的要求,在省级公共资源平台获得中标采购合同,方可按照要求在规定的疫苗管理和冷链监测下配送到疫苗接种单位。
5、使用阶段。
疫苗接种单位按照要求储存接种疫苗。一种新的疫苗上市,必须进行上市后大规模人群的IV期临床的观察,以考察疫苗在大面积人群使用的安全性和有效性。
一般来说,一个疫苗从研发到上市至少要经过八年甚至二十年或者更漫长的阶段,而且在以上任何环节出现安全性等问题都会被叫停,甚至被“毙掉”。
(END)
发表评论